IPTG (イソプロピル-β-D-チオガラクトシド) は、誘導性の高い β-ガラクトシダーゼ基質の類似体です。IPTGの誘導下では、誘導物質はリプレッサータンパク質と複合体を形成することができるため、リプレッサータンパク質の立体構造が変化し、標的遺伝子と結合できなくなり、標的遺伝子が効率的に発現されます。では、実験中に IPTG の濃度はどのように決定すればよいのでしょうか?大きいほど良いのでしょうか?
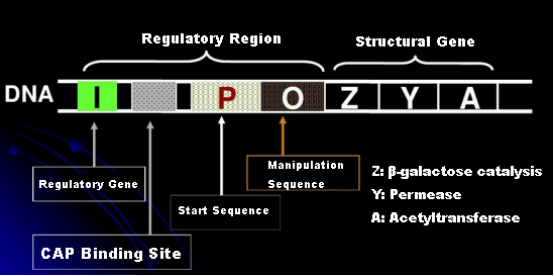
まず、IPTG 誘導の原理を理解しましょう。大腸菌のラクトース オペロン (エレメント) には、それぞれ β-ガラクトシダーゼ、パーミアーゼ、アセチルトランスフェラーゼをコードする 3 つの構造遺伝子 Z、Y、A が含まれています。lacZ はラクトースをグルコースとガラクトース、またはアロラクトースに加水分解します。lacY は、環境中の乳糖が細胞膜を通過して細胞に侵入することを可能にします。lacA はアセチル基をアセチル CoA から β-ガラクトシドに転移します。これには毒性効果の除去が含まれます。さらに、オペレーター配列 O、開始配列 P、および調節遺伝子 I があります。I 遺伝子コードは、オペレーター配列の位置 O に結合できるリプレッサータンパク質であり、オペロン (メタ) が抑制され、オフになりました。開始配列 P の上流には、異化遺伝子活性化タンパク質の結合部位である CAP 結合部位もあります。P 配列、O 配列および CAP 結合部位は一緒になって、lac オペロンの調節領域を構成します。3 つの酵素のコード遺伝子は同じ制御領域によって制御され、遺伝子産物の協調的な発現が実現されます。
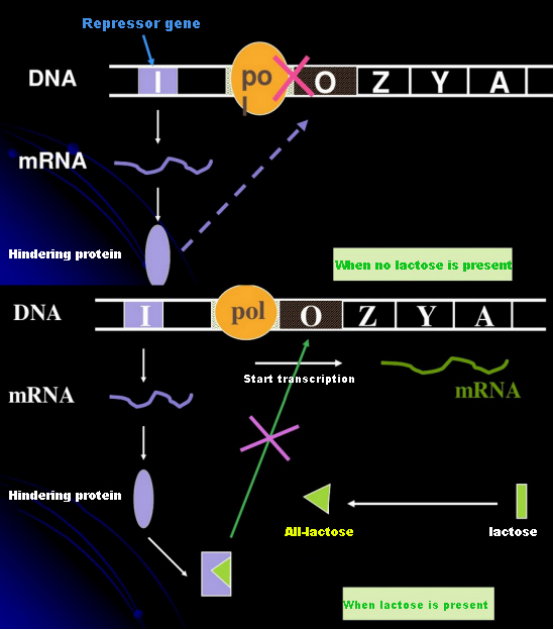
乳糖が存在しない場合、lac オペロン (メタ) は抑制状態になります。このとき、PIプロモーター配列の制御下でI配列によって発現されるlacリプレッサーがO配列に結合し、RNAポリメラーゼがP配列に結合するのを妨げ、転写開始を阻害する。乳糖が存在すると、lac オペロン (メタ) が誘導されます。このオペロン (メタ) システムでは、実際の誘導物質は乳糖そのものではありません。ラクトースは細胞に入り、β-ガラクトシダーゼによって触媒されてアロラクトースに変換されます。後者は誘導分子としてリプレッサータンパク質に結合し、タンパク質の立体構造を変化させ、O 配列からのリプレッサータンパク質の解離と転写を引き起こします。イソプロピルチオガラクトシド (IPTG) はアロラクトースと同じ効果があります。これは非常に強力な誘導物質であり、細菌によって代謝されず、非常に安定しているため、研究室で広く使用されています。
IPTGの最適濃度はどうやって決めるのですか?大腸菌を例に挙げてみましょう。
陽性組換えpGEX(CGRP/msCT)を含む大腸菌BL21遺伝子改変株を、50μg・mL-1 Ampを含むLB液体培地に植菌し、37℃で一晩培養した。上記培養物を50μg・mL-1 Ampを含む50mLの新鮮なLB液体培地10本に1:100の割合で植菌し、OD600値が0.6〜0.8になった時点でIPTGを終濃度まで添加した。0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0mmol・L-1です。同じ温度、同じ時間で誘導した後、細菌溶液 1 mL を採取し、細菌細胞を遠心分離によって収集し、SDS-PAGE に供して、タンパク質発現に対するさまざまな IPTG 濃度の影響を分析しました。タンパク質発現が最大となる IPTG 濃度を選択します。
実験後、IPTG の濃度は可能な限り高くないことがわかります。これは、IPTG が細菌に対して一定の毒性を持っているためです。濃度を超えると細胞も死滅します。一般に、細胞内で発現されるタンパク質の可溶性は高いほど良いと考えられますが、IPTG の濃度が高すぎると、多くの場合、大量の封入体が形成されます。コクはありますが、可溶性タンパク質の量は減少しました。したがって、最適な IPTG 濃度は、多ければ多いほど良いというわけではなく、濃度が低いほど良いことがよくあります。
遺伝子組み換え株の誘導および培養の目的は、目的タンパク質の収量を増加させ、コストを削減することです。標的遺伝子の発現は、菌株自身の因子や発現プラスミドだけでなく、誘導物質の濃度、誘導温度、誘導時間などの外部条件にも影響されます。したがって、一般に、未知のタンパク質を発現および精製する前に、適切な条件を選択して最良の実験結果を得るために、誘導時間、温度、および IPTG 濃度を研究することが最善です。
投稿時間: 2021 年 12 月 31 日

