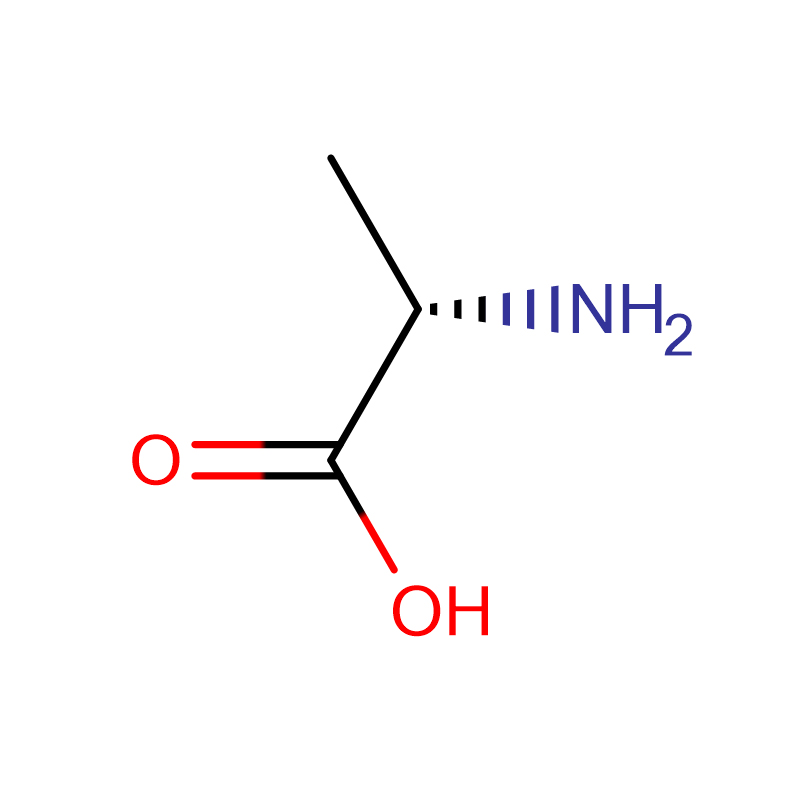
L-アラニン CAS:56-41-7 99% 白色結晶粉末
| カタログ番号 | XD90326 |
| 商品名 | D-アラニン |
| CAS | 338-69-2 |
| 分子式 | C3H7NO2 |
| 分子量 | 89.09 |
| ストレージの詳細 | アンビエント |
| 統一関税法 | 29224985 |
製品仕様書
| 外観 | 白色の結晶性粉末 |
| アッセイ | 98.5~101.5% |
| 特定の回転 | +13.7 ~ +15.1 |
| ヘビーメタル | <0.0015% |
| pH | 5.5~7 |
| SO4 | <0.03% |
| 乾燥減量 | <0.2% |
| 鉄 | <0.003% |
| 強熱時の残留物 | <0.15% |
| 粒子サイズ | 200um |
| Cl | <0.05% |
| 残留性有機汚染物質のレベル | 汚染物質なし |
γ-グルタミルトランスペプチダーゼ(γ-GT)は、グルタチオンのγ-グルタミルアミド結合を切断し、遊離したγ-グルタミル基を水(加水分解)またはアクセプターアミノ酸(ペプチド転移)に転移します。これらの遍在酵素は、グルタチオンの生合成と分解、および生体異物の解毒において重要な役割を果たします。今回我々は、Bacillus licheniformis γ-GT (BlGT) の 3 Å 分解能の結晶構造と、その l-Glu との複合体の結晶構造を報告します。X線構造により、BlGTがN末端求核性加水分解酵素スーパーファミリーに属していることが確認され、このタンパク質が枯草菌由来の相同酵素について報告されているものと同様の開いた活性部位裂を持っているが、ヒトγ-GTおよびヒトγ-GTおよびBlGTで観察されたものとは異なることが明らかになった。他の微生物からのγ-GTの場合。データは、I-Glu の結合が BlGT 大サブユニットの C 末端尾部の再配列を誘導し、金属イオンの認識に関与する可能性がある酸残基のクラスターの同定を可能にすることを示唆しています。BlGT の立体構造安定性に対するこれらの残基の役割は、4 つの新しい Ala 単一変異体の自動プロセシング、酵素活性、化学的変性および熱変性を特徴付けることによって研究されています。結果は、Asp568 の Ala への置換がタンパク質の自動プロセシングと構造安定性の両方に影響を与えることを示しています。
近い